STRUKTURA KRYSZTAŁÓW
Istotną cechą kryształu jest prawidłowe ułożenie jego cząsteczek: atomów i jonów w sieci przestrzennej, w której wyróżnia się węzły, proste i płaszczyzny sieciowe. Najmniejszą część tej struktury, zawierającą wszystkie jej elementy nazywamy komórką elementarną. Komórka ta powtarza się w trzech kierunkach układając się w siatkę przestrzenną. Kryształy są zewnętrznym przejawem tej struktury. Jej regularność wiąże się z istnieniem elementów symetrii takich jak płaszczyzny, osie symetrii - 2-,3-, 4- lub 6-krotne czy środek symetrii. Właśnie te elementy stały się podstawą do wyodrębnienia siedmiu układów krystalograficznych.

Układ regularny
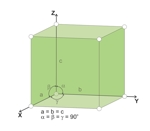 Układ ten cechuje najwyższa symetria. Trzy osie krystalograficzne są do siebie wzajemnie prostopadłe a odcinki między atomami w komórce elementarnej są w trzech kierunkach równe sobie
Układ ten cechuje najwyższa symetria. Trzy osie krystalograficzne są do siebie wzajemnie prostopadłe a odcinki między atomami w komórce elementarnej są w trzech kierunkach równe sobie
Najprostszym przykładem kryształów należących do tego układu jest sześcian halitu, czyli soli kamiennej. Często występuje także postać ośmiościanu, rzadziej dwunastościanu rombowego, dwunastościanu pięciokątnego a nawet czterdziestoośmiościanu.
Kryształy należące do klasy czterdziestoośmiościanu zawierają największą z możliwych ilość elementów symetrii: trzy osie czterokrotne, cztery osie trójkrotne, sześć osi dwukrotnych, dziewieć płaszczyzn symetrii i środek symetrii.
W układzie regularnym krystalizuje ponad 26 % minerałów, między innymi diament, magnetyt, fluoryt, galena, halit, uraninit, granaty, spinele oraz metale rodzime: złoto, srebro, miedź i platyna.
Układ heksagonalny
Układ heksagonalny cechuje obecność czterech osi krystalograficznych (nie trzech, jak we wszystkich pozostałych układach)
Pionowa oś jest o symetrii sześciokrotnej, prostopadłe do niej są trzy osie ułożone względem siebie pod kątem 120°. Odcinki między atomami w kierunku tych osi są jednakowe, lecz różne w stosunku do odcinków na osi sześciokrotnej, sześć osi dwukrotnych, siedem płaszczyzn symetrii i środka symetrii.
W układzie heksagonalnym krystalizuje 9% minerałów, najbardziej znane to grafit, beryl, molibdenit, kowelin, apatyt i lód.
Układ tetragonalny
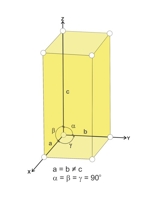 Układ tetragonalny cechuje prostopadły układ osi krystalograficznych, oś pionowa jest osią czterokrotną, prostopadłe do niej dwie osie poziome są osiami dwukrotnymi, odcinki między atomami na osiach poziomych są równe, a różne od odcinków na osi pionowej.
Układ tetragonalny cechuje prostopadły układ osi krystalograficznych, oś pionowa jest osią czterokrotną, prostopadłe do niej dwie osie poziome są osiami dwukrotnymi, odcinki między atomami na osiach poziomych są równe, a różne od odcinków na osi pionowej.
W najbardziej symetrycznej klasie tego układu występuje oś czterokrotna, cztery osie dwukrotne, pięć płaszczyzn symetrii i środek symetrii.
W układzie tym krystalizuje ponad 12% minerałów, najbardziej znane to rutyl, kasyteryt, apofyllit, cyrkon, wezuwian i chalkopiryt.
Układ trygonalny
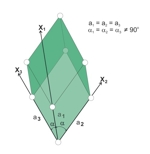 Układ trygonalny, zwany również romboedrycznym, cechuje szczególny układ osi krystalograficznych, które nie są do siebie prostopadłe, lecz ułożone tak, jak krawędzie romboedru. Odcinki między atomami mierzone względem osi są równe
Układ trygonalny, zwany również romboedrycznym, cechuje szczególny układ osi krystalograficznych, które nie są do siebie prostopadłe, lecz ułożone tak, jak krawędzie romboedru. Odcinki między atomami mierzone względem osi są równe
W najbardziej symetrycznej klasie tego układu jest oś trójkrotna, trzy osie dwukrotne, trzy płaszczyzny symetrii i środek symetrii.
W układzie tym krystalizuje ponad 11% wszystkich minerałów. Najbardziej znane z nich to: kwarc, korund, hematyt, kalcyt, dolomit, syderyt, turmalin, cynober, oraz metale rodzime: bizmut, arsen, selen i tellur.
Układ rombowy
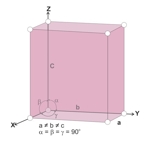 Układ rombowy cechuje prostopadłość trzech osi krystalograficznych a jednocześnie różna długość odcinków między atomami na wszystkich osiach (komórka elementarna ma kształt cegły i zawiera charakterystyczne dla cegły elementy symetrii). Różna długość odcinków na osiach jest powodem, że mimo prostokątnego układu osi symetria układu jest niższa od symetrii układów regularnego i tetragonalnego
Układ rombowy cechuje prostopadłość trzech osi krystalograficznych a jednocześnie różna długość odcinków między atomami na wszystkich osiach (komórka elementarna ma kształt cegły i zawiera charakterystyczne dla cegły elementy symetrii). Różna długość odcinków na osiach jest powodem, że mimo prostokątnego układu osi symetria układu jest niższa od symetrii układów regularnego i tetragonalnego
Najbardziej symetryczne kryształy układu rombowego mają trzy osie dwukrotne, trzy płaszczyzny symetrii i środek symetrii.
W układzie rombowym krystalizuje ponad 19% wszystkich minerałów, najbardziej znane z nich to antymonit, aragonit, baryt, celestyn, markasyt i siarka rodzima.
Układ jednoskośny
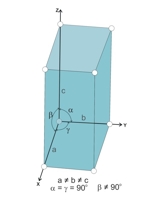 Kryształy jednoskośne cechuje obecność trzech osi, które przecinają się tak, że dwa kąty między nimi są kątami prostymi, jeden jest różny od prostego, a odcinki między atomami komórki elementarnej na wszystkich osiach są różne.
Kryształy jednoskośne cechuje obecność trzech osi, które przecinają się tak, że dwa kąty między nimi są kątami prostymi, jeden jest różny od prostego, a odcinki między atomami komórki elementarnej na wszystkich osiach są różne.
Najbardziej symetryczne kryształy tego układu mogą mieć jedną oś podwójną, jedną płaszczyznę symetrii i środek symetrii.
W układzie jednoskośnym krystalizuje ponad 21% minerałów, najbardziej znane przykłady to gips, ortoklaz, augit, diopsyd, epidot, amfibol.
Układ trójskośny
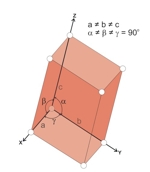 Układ trójskośny jest najmniej symetryczny ze wszystkich. Żadna z trzech osi krystalograficznych nie tworzy z pozostałymi kąta prostego, kryształy nie mają więc ścian prostopadłych do siebie. Odcinki między atomami komórki elementarnej są w trzech głównych kierunkach różne.
Układ trójskośny jest najmniej symetryczny ze wszystkich. Żadna z trzech osi krystalograficznych nie tworzy z pozostałymi kąta prostego, kryształy nie mają więc ścian prostopadłych do siebie. Odcinki między atomami komórki elementarnej są w trzech głównych kierunkach różne.
Kryształy trójskośne mogą mieć co najwyżej środek symetrii, a najmniej symetryczne nie mają żadnego elementu symetrii.
W układzie tym krystalizuje stosunkowo niewiele minerałów (2%), ale jest on bardzo pospolity w przyrodzie, gdyż należą do niego minerały skałotwórcze z grupy skaleni: plagioklazy (skalenie sodowo-wapniowe) i mikroklin (skaleń potasowy); do minerałów trójskośnych należą m. in. pikromeryt, także dysten, aksynit i rodonit.
Poszczególne kryształy zalicza się do danego układu zgodnie z charakterystycznymi dla nich elementami symetrii np. wyróżnikiem układu heksagonalnego jest m. in. jedna oś sześciokrotna a w przypadku układu regularnego cztery osie trójkrotne.
W obrębie układów wyróżnia się 32 klasy krystalograficzne czyli grupy kryształów zawierających takie same elementy zewnętrznej symetrii.
Badania zewnętrznej postaci kryształów i stworzone na drodze dedukcji wzory rozmieszczenia cząstek w sieci przestrzennej zostały potwierdzone w 1912 r. przez badania za pomocą promieni Roentgena.
Każdy układ krystalograficzny tworzy charakterystyczne, indywidualne formy zależne od składu chemicznego i warunków fizycznych panujących w trakcie powstania kryształów, zwłaszcza temperatury i ciśnienia. Idealne wykształcenie wszystkich ścianek kryształu spotyka się rzadko, ponieważ wpływy zewnętrzne mogą zmieniać prędkość wzrostu poszczególnych ścianek kryształu. Doprowadza to do zniekształceń i mimo, że każdy minerał krystalizuje tylko w jednym układzie jego postać może być różna. Cechę tę nazywamy pokrojem. Poszczególne rodzaje pokroju opisują ich trójwymiarowy kształt. I tak rozróżnia się pokrój izometryczny, w którym wymiary we wszystkich kierunkach są zbliżone, słupkowy, igiełkowy, blaszkowy oraz tabliczkowy. Nierównomierny wzrost ścian może spowodować, że dwa kryształy tej samej substancji, ograniczone identycznymi ścianami mogą mieć pokrój bardzo różny. Przy badaniach te zniekształcenia nie są tak istotne, gdyż najważniejsze są kąty między tymi ścianami. Opisuje to prawo stałości kątów, sformułowane w 1669 r. przez Nielsa Stensena (łac. M. Stenona), uznawane za podstawowe prawo krystalografii, głoszące, że w kryształach tego samego minerału kąty między odpowiadającymi sobie ścianami są zawsze jednakowe. Niezależna od różnic pokroju stałość kątów między ścianami jest ważną cechą diagnostyczną kryształów minerałów, każdy z nich bowiem (z wyjątkiem kryształów układu regularnego) ma właściwe tylko sobie wzajemne nachylenie ścian.